Farmacija >
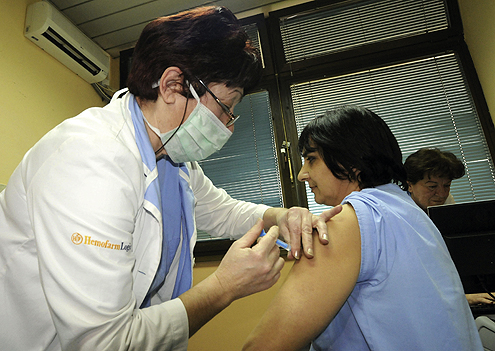
Hemofarm nepoželjan u SAD
Vest da je američka agencija za kontrolu hrane i lekova FDA zabranila dalji uvoz Hemofarmovih injekcionih bočica u SAD, jer je u njima pronađena veoma opasna, u nekim slučajevima i smrtonosna bakterija Burkholderia cepacia, uznemirila je ne samo američku već i ovdašnju javnost.
U pitanju nisu zaražene injekcije, već prazne bočice koje se naknadno pune tečnošću i serumom. To znači, upozorio je FDA, da su bočice koje su izašle iz Hemofarmovih postrojenja bile inficirane bakterijom pre nego što su stigle do krajnjeg kupca.
Lekari su upozorili da je reč o veoma otpornoj i opasnoj bakteriji, prvi put registrovanoj na našim prostorima. Bakterija izaziva oboljenje pluća, može da bude opasna po život i toliko je rezistentna i uporna da je pronalažena čak i u dezinfekcionim sredstvima poput rastvora joda.
Ministar zdravlja Srbije Zoran Stanković, međutim, tvrdi da inspekcijske službe u postrojenjima Hemofarma do sada nisu našle smrtonosnu bakteriju, te da je američka agencija za hranu i lekove "zaobišla" državne organe Srbije i tako i državi i Hemofarmu nanela težak udarac.
Ministar je dodao da ranije nije bio upoznat s pismom FDA i da ne želi da ga komentariše pre nego što Hemofarm odgovori na navode američke agencije, uz opasku da Ministarstvo i Agencija za lekove i medicinska sredstva (ALIMS) kontrolišu proizvode Hemofarma i da su, prema njegovim saznanjima, "lekovi te kompanije sigurni i nema opasnosti po zdravlje ljudi koji ih koriste".
Opasna bakterija, međutim, nije jedini razlog zbog koga je američka agencija obustavila uvoz Hemofarmovih proizvoda. Rukovodstvo ove kompanije je zbog brojnih propusta prvi put upozoreno još prošle godine.
Pošto propusti u međuvremenu nisu otklonjeni, FDA je pre gotovo mesec dana uputila pismo Hemofarmu, objavljeno i na njihovom sajtu, u kome se navodi da su uslovi u kojima se lekovi proizvode, pakuju ili čuvaju ne poklapaju s važećim standardima.
Vršačka farmaceutska kompanija Hemofarm saopštila je 16. jula da pismo upozorenja FDA ne uzima u obzir sve mere optimizacije od januara 2012, već se poziva na zastarelo tehničko stanje i procese iz prošle godine, a koji su u međuvremenu unapređeni, kao i da je dosad već okončana proizvodnja za američko tržište "isključivo iz komercijalnih razloga".
"Nakon šest meseci detaljne analize i detaljnog redizajniranja proizvodnog procesa, proizvodna linija je prošla nekoliko unutrašnjih i spoljašnjih revizija i proizvodnja je mogla biti obnovljena u decembru 2011. U našoj oceni kvaliteta, koju su podržali nezavisni spoljni evropski i američki stručnjaci, nijedan proizvod date aseptične proizvodne linije, distribuiran od strane Hemofarma na bilo koje tržište, nije bio pod uticajem opisanog problema. O našim sveobuhvatnim naporima smo detaljno obavestili FDA u više dokumenata", zaključuje se u saopštenju ove farmaceutske kuće.
 POŠALJI KOMENTAR REDAKCIJI
POŠALJI KOMENTAR REDAKCIJI
|  |
 ODŠTAMPAJ TEKST
ODŠTAMPAJ TEKST
|
|||
 | |||||
|
| |||||

IZ ISTOG BROJA
-
>
Foto nedelje
"nedelju" uređuje jasmina lazić -
Broj nedelje >
89
-
Mediji >
Ko je novi suvlasnik Politike
R. V. -
Novogovor >
Pranje novca
Milan Milošević -
Teodor fon Burg >
Najbolji matematičar na svetu
R.V. -
Društvo >
Heroj ulice
Đurđica Bogosavljević